In letzter Zeit hat sich die Immuntherapie als innovative Methode zur Behandlung von Krebserkrankungen hervorgetan. Der Einsatz des Immunsystems zur Bekämpfung von Tumoren ist mit weniger toxischen Stoffen verbunden als zuvor, und es kann zielgerichteter sowie wirksamer gearbeitet werden als mit herkömmlichen Behandlungsmethoden wie Chemo- und Strahlentherapien. Die CAR-T-Zell-Therapie, eine der vielversprechendsten verfügbaren Therapien, bietet eine sehr innovative Wirkungsweise in Bezug auf komplexe Erkrankungen, wie Krebs.
CAR-T-Zellen werden aus T-Zellen gebildet, die ein wichtiger Bestandteil unseres Immunsystems sind. Die T-Zellen werden entweder anhand von „autologen“ Therapien aus dem Körper des Patienten gewonnen (zwei Produkte wurden bereits von der US-amerikanischen Lebensmittelüberwachungs- und Arzneimittelbehörde zugelassen, die entscheidet, welche Arzneimittel in den USA eine Marktzulassung erhalten), oder sie stammen von einem gesunden Spender. In letzterem Fall wird von „allogenen“ Therapien gesprochen, die sich derzeit in präklinischen und klinischen Entwicklungsphasen befinden. Um Krebserkrankungen bekämpfen zu können, müssen die Zellen über einen chimären Antigen-Rezeptor (Chimeric Antigen Receptor, CAR) „verfügen“, damit sie Krebszellen besser erkennen und abtöten können. Diese Modifikation wird in Speziallabors durchgeführt, wo der genetische Code lebender T-Zellen erzeugt wird, um CAR zu exprimieren. Dann können die CAR-T-Zellen wieder in den Organismus des Patienten injiziert werden, damit der Kampf gegen den Krebs beginnen kann.
Stellen die CAR-T-Zellen eine revolutionäre Methode dar, die die Krebsbehandlungsmöglichkeiten nachhaltig verändern wird? Die Methode wird derzeit intensiv weiterentwickelt, aber bislang gilt es noch viele Hindernisse zu überwinden, um diese Therapien weltweit wirksam einsetzen zu können. Die derzeit verfügbaren Technologien sind mit Einschränkungen verbunden, die auf die hohen Produktionskosten sowie logistische Herausforderungen zurückzuführen sind, insbesondere im Zusammenhang mit den verfügbaren autologen Therapien. Stellen allogene oder „gebrauchsfertige“ CAR-T-Zell-Behandlungen unter diesen Umständen eine besser zugängliche und kostengünstigere Lösung dar?
Geschichtlicher und wissenschaftlicher Hintergrund
Die T-Zellen sind innerhalb des Immunsystems dafür verantwortlich, infizierte, krebserregende oder geschädigte Zellen abzutöten[1]. Leider gelingt es Krebszellen jedoch manchmal, sich zu verstecken: Das Immunsystem erkennt sie nicht, weshalb die natürlichen Überwachungsmechanismen nicht greifen. Deshalb kamen Wissenschaftler auf die Idee, die T-Zellen so zu perfektionieren, dass sie diese Zellen besser aufspüren und zerstören können. Sie haben den T-Zellen eine Waffe in Form eines genetischen Codes mitgegeben: die chimären Antigen-Rezeptoren (Chimeric Antigen Receptors, CAR). Die CAR haben zwei Aufgaben: Sie sollen bestimmte Biomarker (Antigene) an Krebszellen binden und die krebszerstörenden Mechanismen aktivieren.
„... up to 90% of leukaemia patients achieved complete and durable disease remission ...“
Im Rahmen jahrzehntelanger Laborarbeit wurde aus dieser innovativen Idee eine wirksame Behandlung für die Patienten: Das Konzept der externen Modifikation der Immunzellen von Patienten zur Optimierung ihrer krebskontrollierenden Eigenschaften wurde erstmals vor 30 Jahren dargelegt[2]. 2015 feierte die CAR-T-Technologie dann einen großen Erfolg: Im Rahmen mehrerer klinischer Studien wurde bei bis zu 90 % der Leukämiepatienten eine vollständige, dauerhafte Remission festgestellt[3] [4]. Seitdem ist die Anzahl von Forschungsarbeiten und klinischen Studien im Zusammenhang mit derartigen Therapien exponentiell gestiegen: Bis Ende Mai wurden weltweit bereits 293 laufende Studien zu CAR-T-Zellen durchgeführt[5], 2017 im Vergleich dazu nur 152[6]. Im Jahr 2018 wurden zwei dieser Therapien zur Behandlung von Leukämie und Lymphomen in den USA und Europa zugelassen: Yescarta von Gilead Sciences und Kymriah von Novartis (kürzlich auch als einzige CAR-T-Zell-Therapie in Asien zugelassen)[7]. Beide Behandlungen erfordern die Verwendung von Patientenzellen zur Herstellung des therapeutischen Produkts.
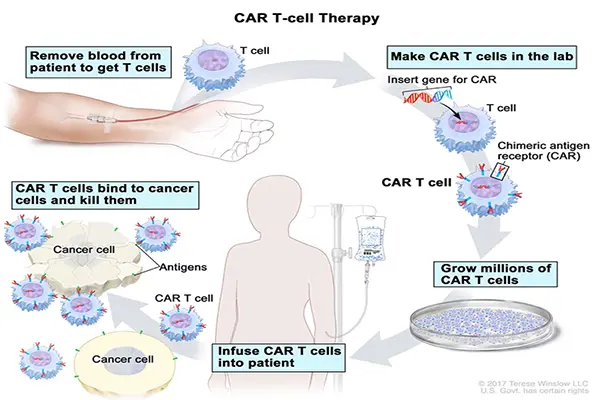
CAR-T-ZELL-BEHANDLUNG (https://www.cancer.gov/types/leukemia/patient/child-all-treatment-pdq)/
CAR-T-Zellen werden durch Einsetzen eines Gens in die T-Zelle hergestellt. Dieses Gen ermöglicht die Kodierung des chimären Antigen-Rezeptors: CAR (ein kleines, synthetisches Protein, das ab diesem Zeitpunkt von der Zelle produziert wird und sich auf ihrer Oberfläche präsentiert). Die Funktion der CAR besteht darin, einen bestimmten Biomarker (ein Antigen) an die Krebszelle zu binden. Nach der Bindung an das Krebsantigen wird die CAR-T-Zelle durch den Teil des CAR aktiviert, der in die T-Zelle gelangt und die krebszerstörenden Mechanismen aktiviert.
Anspruchsvolle Produktionsmechanismen, komplexe logistische Leistung
Im Verlauf der Produktion dieser individuellen Behandlung werden dem Patienten die weißen Blutkörperchen entnommen. Aus ihnen werden die T-Zellen extrahiert, die an eine spezialisierte Produktionsstätte geschickt werden, wo sie mit CAR bestückt werden. Dann werden die modifizierten T-Zellen kultiviert, um eine ausreichende therapeutische Dosis zu erhalten. Anschließend wird das vorbereitete Produkt an das Krankenhaus zurückgesendet, damit es dem Patienten verabreicht werden kann. Dieser Prozess dauert etwa drei Wochen und macht zwei komplexe Kreisläufe in der Kühllogistik erforderlich. Die Zellen müssen eingefroren werden, damit sie sich so lange wie möglich halten. Außerdem muss die Zuordnung zu dem entsprechenden Patienten gewährleistet werden, damit die Zellen dem richtigen Patienten verabreicht werden[8]. Zudem muss es schnell gehen, da diese Therapie vor allem bei Patienten eingesetzt wird, bei denen es nach anderen Behandlungen zu einem Rückfall gekommen ist. Deshalb ist es gegebenenfalls nicht möglich, ein „therapeutisches Fenster“ einzuhalten, da die Erkrankung zu schnell fortschreitet. Darüber hinaus ist es in einigen Fällen aufgrund des Zustands des Patienten (und seiner T-Zellen) nicht möglich, die CAR-T-Zellen zu produzieren. Bei den klinischen Studien, die vor der Zulassung von Yescarta durchgeführt wurden, erhielt beispielsweise einer der 111 Patienten das Produkt aufgrund eines Fehlers im Herstellungsprozess nicht. Neun weitere Patienten wurden aufgrund des Krankheitsverlaufs oder schwerer Komplikationen nach der Entnahme ihrer Zellen nicht behandelt[9]. Generell ist die Herstellung von CAR-T-Zellen logistisch gesehen komplex, zeitaufwändig und teuer. Darüber hinaus ist es schwierig, die Qualität des Endprodukts zu kontrollieren: Jeder Patient ist anders und das Gleiche gilt für seine T-Zellen und die daraus gewonnenen CAR-T-Zellen. Die Patienten, die das Ausgangsmaterial im Rahmen der autologen Therapie zur Verfügung stellen, weisen viele unterschiedliche Krankheitsgeschichten sowie Krankheitsstadien und sehr unterschiedliches genetisches Erbgut auf. All diese Faktoren tragen zu den Komplikationen bei, die vor dem Produktionsprozess auftreten. Dieses Verfahren unterscheidet sich daher deutlich von einem standardisierten, gut definierten Herstellungsprozess.
„Bei einem Produkt, das von den Patienten selbst stammt und von so vielen Variablen abhängt, ist es schwierig, ein traditionelles Preismodell zu vertreten“
Kosten als Hinderungsgrund
Bei einem Produkt, das von den Patienten selbst stammt und von so vielen Variablen abhängt, ist es schwierig, ein traditionelles Preismodell zu vertreten, bei dem Forschung und Entwicklung, Fertigung und Logistik berücksichtigt werden. Es wäre möglich, ein ergebnisorientiertes Modell zu wählen: Der Preis des Medikaments hängt vom Nutzen und nicht von den Kosten für Entwicklung und Herstellung ab. Allerdings kann es riskant sein, dieses Preissystem für lebenswichtige Arzneimittel zu verwenden: Da CAR-T-Zellen oft als letztes Mittel eingesetzt werden, würde dies nahezu einer Kostenschätzung des menschlichen Lebens gleichkommen[10]. Nichtsdestotrotz investieren Pharmaunternehmen große Summen: Novartis hat seit 2012 mehr als 1 Milliarde US-Dollar ausgegeben, um Kymriah auf den Markt zu bringen, und Gilead hat fast 12 Milliarden US-Dollar für den Kauf von Kite Pharma bezahlt, das Unternehmen, das Yescarta entwickelt hat. Ursprünglich hatte Novartis vorgeschlagen, dass nur Patienten, die im ersten Behandlungsmonat auf die Therapie ansprechen, der volle Preis für Kymriah berechnet würde, inzwischen ist die Idee jedoch verworfen worden[11]. Jecarta und Kymriah kosten 373.000 US-Dollar bzw. 475.000 US-Dollar pro Patient. Im Jahr 2018 betrug der Umsatz im Zusammenhang mit Yescarta 264 Millionen US-Dollar, und im ersten Quartal 2019 wurden 96 Millionen US-Dollar Umsatz erzielt, ein Wert, der leicht unter dem Zielwert von 105 Millionen US-Dollar lag. Der Umsatz im Zusammenhang mit Kymriah betrug im Jahr 2018 76 Millionen US-Dollar und im ersten Quartal 2019 45 Millionen US-Dollar[12] . Aufgrund des hohen Preises besteht im Hinblick auf die Therapie eine gewisse Zurückhaltung von Seiten der Zulassungsbehörden und Versicherungsgesellschaften. Deshalb würden sich niedrigere Produktionskosten positiv auf die Zugänglichkeit der CAR-T-Behandlungen auswirken.
Gesunde Spender: eine Lösung, ...,
Die meisten der oben genannten Probleme könnten durch allogene Therapien gelöst werden, für die anstelle von Patientenzellen Zellen von gesunden Spendern verwendet werden, die nicht mit den Patienten verwandt sind. Zellen von gesunden Spendern sind leichter verfügbar. Dadurch ist es möglich, nur T-Zellen zu entnehmen, die optimal für die Krebsbekämpfung geeignet sind. Das ist nicht möglich, wenn das Arzneimittel aus Zellen des Patienten gewonnen wird und es nur wenige Zellen gibt, die gegen den Krebs ankämpfen können. Abgesehen davon wäre bei den gebrauchsfertigen CAR-T-Zellen im Gegensatz zum autologen CAR-T-Ansatz, bei dem das Therapieergebnis von einer einzigen Behandlungsdosis abhängig ist, gegebenenfalls die Flexibilität einer wiederholten Verabreichung gegeben. Außerdem würde sich durch den Einsatz von Spenderzellen möglicherweise eine Qualitäts- und Sicherheitsoptimierung in Bezug auf das Endprodukt ergeben. Abgesehen davon könnten die hohen Kosten der Kühllogistik, die oftmals den Transport über mehrere Kontinente hinweg erfordert, theoretisch um die Hälfte reduziert werden, da die von Spendern stammenden, mit CAR versehenen Zellen nur einmal transportiert werden müssten – von der Produktionsstätte zum Krankenhaus. Wenn es gelingen sollte, einen kostengünstigeren Herstellungs- und Lieferprozess zu ermöglichen, werden die Preise spürbar sinken, die Versicherungsgesellschaften werden eher dazu bereit sein, diese Therapien zu erstatten, und für die Patienten werden sie leichter zugänglich sein.
... aber auch neue Herausforderungen
Die Krebstherapie mit Zellen von gesunden Spendern bietet zwar gute Überlebenschancen für die Patienten, birgt aber erhebliche Risiken, und es bestehen nach wie vor viele Unwägbarkeiten. Erstens ähnelt dieses Verfahren einer Transplantation, wie z. B. einer Knochenmark-Stammzelltransplantation, bei der Spender und Empfänger absolut kompatibel sein müssen, um eine Graft-versus-Host-Reaktion (GVH) zu vermeiden. Diese Erkrankung tritt auf, wenn inkompatible CAR-T-Zellen injiziert wurden und nicht nur die Krebszellen, sondern auch alle anderen Zellen des Wirtsorganismus (der Patient) angreifen. Gleichzeitig kann es vorkommen, dass das Immunsystem des Patienten die Fremdzellen angreift und tötet, bevor sie den Krebs zerstören können. In einem solchen Fall spricht man von einer Host-versus-graft-Reaktion (HVG). Es gibt verschiedene Möglichkeiten, um diese Probleme zu lösen. Beispielsweise, nach kompatiblen Spendern und Empfängern zu suchen[13]. Leider scheint diese Strategie jedoch aufgrund der großen Unterschiede sowohl bei den Patienten als auch bei den potenziellen Spendern zu zeitaufwendig zu sein, um praktisch umgesetzt werden zu können. Deshalb haben die Wissenschaftler eine Möglichkeit gefunden, um dieses Hindernis zu umgehen. Wie wir gesehen haben, ist bei der Herstellung von CAR-T-Zellen (sowohl für autologe als auch für allogene Behandlungen) der wichtigste Schritt, ein chimäres Protein hinzuzufügen, das sich an den Krebs an der Oberfläche der Zelle bindet. Bei Zellen eines externen Spenders sind zusätzliche Modifikationen erforderlich, die mit Hilfe einer Genom-Editierung erfolgen können[14]. Um beispielsweise die Sicherheit der Spenderzellen für den Patienten zu gewährleisten und GVH zu vermeiden, ist es möglich, ein Molekül namens T-Zell-Rezeptor (TZR) von der Zelloberfläche zu entfernen. Um HVG zu verhindern, muss zudem sichergestellt werden, dass das Immunsystem des Patienten die Fremdzellen nicht erkennen kann. In diesem Zusammenhang sind verschiedene Strategien möglich, wie z. B. die Reduzierung des Proteingehalts β2M. Es ist zwar nicht einfach, all diese Änderungen vorzunehmen, aber dank des Engagements vieler Wissenschaftler ist es bereits möglich.
Die Wettbewerbslandschaft und die Aussicht auf viele neue Produkte zum Jahresende
Trotz all dieser neuen Herausforderungen werden weltweit gebrauchsfertige CAR-T-Zell-Therapien entwickelt, und das wachsende Interesse an auf Spenderzellen basierenden Therapien spiegelt sich bereits in den Statistiken von Kühllogistikunternehmen wie Cryoport wider, das zu den führenden Logistikanbietern für temperaturempfindliche Materialien (wie beispielsweise Arzneimitteln aus Lebendzellen) zählt. Im ersten Quartal 2019 erbrachte das Unternehmen mehr als 30 % seiner Dienstleistungen im Rahmen von klinischen Studien für allogene Therapien.
„Trotz all dieser neuen Herausforderungen werden weltweit gebrauchsfertige CAR-T-Zell-Therapien entwickelt“
Die erste von Cellectis durchgeführte klinische Studie zu diesen Therapien im Hinblick auf rezidivierende/refraktäre, akute lymphoblastische Leukämie hat sehr unterschiedliche Ergebnisse ergeben. Insgesamt gesehen waren die Ergebnisse sicher sehr ermutigend, da die meisten Patienten positiv auf die Behandlung ansprachen. Allerding sind auch zwei Patienten aufgrund einer Therapietoxizität gestorben[15]. Das Programm von Cellectis für den Einsatz von allogenen CAR-T-Zell-Therapien und das Portfolio präklinischer Zelltherapiewirkstoffe von Pfizer werden von Allogene in Zusammenarbeit mit Servier entwickelt. Allogene wurde von zwei ehemaligen Führungskräften von Kite Pharma gegründet, nachdem diese aufgehört hatten, bei Gilead zu arbeiten. Im kommenden Jahr wird das Unternehmen voraussichtlich einen Bericht über die ersten Ergebnisse seiner Behandlung akuter lymphatischer Leukämie veröffentlichen. Die klinische Studie bezüglich des rezidivierenden/refraktären Non-Hodgkin-Lymphoms hat gerade erst begonnen. Cellectis ist außerdem an der Entwicklung von drei weiteren Produkten für die allogene T-CAR-Zell-Therapie im Rahmen klinischer Studien beteiligt, die jeweils mittels eines bestimmten Tumorantigens auf verschiedene Krebsarten abzielen. Bis Ende des Jahres ist mit einer aussagekräftigen Datenaktualisierung zu rechnen. Im November 2018 gab Celyad darüber hinaus bekannt, sein Therapeutikum AlloSHRINK CYAD-101 zur Behandlung von inoperablem metastasierendem Darmkrebs einem ersten Patienten injiziert zu haben. CYAD-101 ist aus einer früheren Zusammenarbeit zwischen Celyad und dem japanischen Unternehmen ONO Pharmaceutical hervorgegangen, das derzeit mit Fate Therapeutics an der Entwicklung von zwei neuen gebrauchsfertigen Zelltherapien arbeitet. Das präklinische Projekt von Fate unterscheidet sich deutlich dadurch von allen anderen CAR-T-Zell-Therapien, dass statt Spenderzellen induzierte, pluripotente Stammzellen verwendet werden. Außerdem hat für das allogene Arzneimittel, das Precision Biosciences ins Rennen schickt, im April die klinische Phase begonnen. Es ist für die Behandlung von rezidivierenden/refraktären Non-Hodgkin-Lymphomen und akuter lymphoblastischer Leukämie Typ B gedacht. Die ersten Ergebnisse werden Ende 2019 oder Anfang 2020 erwartet. Die CRISP Therapeutics AG wiederum, die sich der Genom-Editierung widmet, wird dieses Jahr im Rahmen seines Programms CTX110 CD19 allo-CAR-T mit klinischen Studien beginnen. Das Konkurrenzunternehmen Editas Medicine arbeitet ebenfalls an der Entwicklung allogener, zellulärer Behandlungen zur Krebsbekämpfung und Gilead wird in Zusammenarbeit mit Sangamo KITE-037 zu entwickeln, ein Projekt, dessen klinische Phase 2020 beginnen soll. Und ATARA Biosciences, ein Unternehmen, das derzeit die allogene T-Zell-Immuntherapie zur Behandlung von Virusinfektionen und Krebserkrankungen durch Virusinfektionen erforscht, hat im Rahmen seiner präklinischen Entwicklung mit vier CAR-T-Projekte begonnen.
„Je mehr sich die Gesundheitsgesellschaften für den Kampf gegen den Krebs stark machen, desto mehr innovative Immuntherapien gibt es“
Je mehr sich die Gesundheitsgesellschaften für den Kampf gegen den Krebs stark machen, desto mehr innovative Immuntherapien gibt es. Derzeit gibt es weltweit rund 140 Unternehmen mit mindestens einem Therapieprogramm auf Basis von CAR-T-Zellen . Desweiteren arbeiten viele Unternehmen im Labor und im Rahmen klinischer Studien gezielt an gebrauchsfertigen CAR-T-Zellen. Candriam hat sich zum Ziel gesetzt, die vielversprechendsten Entwicklungen zu fördern. Wir beobachten die technologischen Fortschritte in diesem Bereich sehr genau. Diese gründliche Analyse beinhaltet insbesondere eine sorgfältige Evaluierung innovativer Technologien und eine Einschätzung ihrer potenziellen Auswirkungen auf das Verhalten der Unternehmen, die sie entwickeln. Candriam plant, in die dynamischsten Unternehmen zu investieren, die im onkologischen Bereich tätig sind.
[1] https://www.nature.com/subjects/cytotoxic-t-cells
[2] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC298636/
[3] http://embomolmed.embopress.org/content/early/2017/07/31/emmm.201607485.long#DC4
[4] https://www.ncbi.nlm.nih.gov/pubmed/25317870?dopt=Abstract
[5] https://clinicaltrials.gov
[6] https://celltrials.org/public-cells-data/all-car-t-trials-cumulative-through-end-2017/56
[7] https://www.novartis.com/news/media-releases/kymriahr-tisagenlecleucel-first-class-car-t-therapy-from-novartis-receives-second-fda-approval-treat-appropriate-rr-patients-large-b-cell-lymphoma
[8] https://www.biopharmadive.com/news/car-t-supply-chain-cell-therapy-challenges-pharma/521560/
[9] https://www.yescarta.com/files/yescarta-pi.pdf
[10] https://www.europeancancerleagues.org/wp-content/uploads/2018/06/CAR-T-ECL-Article_Final_20062018.pdf
[11] https://cancerworld.net/cutting-edge/the-car-t-cell-revolution-what-does-it-offer-and-can-we-afford-it/
[12] https://www.evaluate.com/vantage/articles/news/corporate-strategy/novartis-hopes-kymriah-acceleration-can-save-its-car
[13] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088751/
[14] https://www.ncbi.nlm.nih.gov/pubmed/30735463
[15] https://servier.com/wp-content/uploads/2018/12/PR_Servier-Allogene_ASH2018.pdf
[16] Bildungsveranstaltung mit dem Titel „Driving CARs in Aggressive Lymphoma“ (Förderung von CAR-T-Therapien zur Behandlung von aggressiven Lymphomen) auf der ASCO-Jahrestagung 2019, vom 31. Mai bis 4. Juni 2019.
